티스토리 뷰
친전자성 반응과 친핵성 반응
친전자성과 친핵성. 많이 들어본 말이지만 헷갈려서 다시 정리한다.
친전자성 반응 electrophilicity
친전자성: 전자와 친한, 전자를 좋아한다 전자를 좋아하므로 전자쌍 받개(전자를 빼앗음)를 시약으로 사용한다.
- Lewis 산 을 시약으로 사용한다.
즉, 반응을
주도하는 물질이 친전자체일때 친전자성 반응이며, 반응의 시작부터 끝까지 전자를 빼앗는 물질이 주도한다.
전자를 뺏기는 상황이 벌어지므로 주로 양이온성 중간 물질(+)들이 생성된다.
반응이 일어나는 부분은 분자 내의 가장 전자밀도 높은 곳이다. 반결합성 orbital에서 반응이 일어난다. 결합성 orbital은 두 핵의 인력을 최대로 받는 부분이므로 전자를 뺏기가 쉽지 않기 때문이다. 그에 비해 반결합성 orbital은 한 개의 핵에서만 인력을 받기 때문에 주로 전자밀도가 가장 높은 부분에서 일어난다.
예) 친전자성 첨가 반응
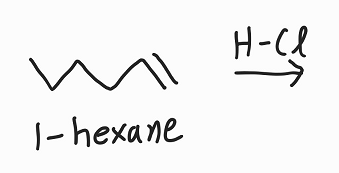
1-hexane의 경우 반응성이 그리 높지 않다. 그에 비해 HCl에 비해 반응성이 크다.
- 물에 용해되면 H+와 Cl-로 해리되어 있고, 유기 용매에서는 쉽게 해리되지 않고 H쪽은 δ+, Cl쪽은 δ-일 것이다.
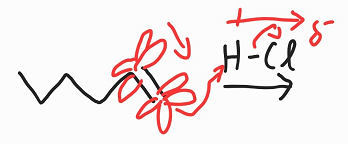
H는 전자밀도가 낮아, 전자를 받아들이려는 성질이 강하다. 아까 말했듯이 결합성쪽의 전자는 뺏기 쉽지 않을 것이고, π*는 양쪽에 두 군데이다. 한쪽은 여러 결합의 반발력으로 전자가 상대적으로 없고 다른쪽은 전자 밀도가 상대적으로 높을 것이다.
따라서 말단쪽의 전자는 H-Cl의 H와 결합하고, Cl은 음이온 상태(-)가 된다. 결합성 orbital의 안쪽 부분은 양이온 상태(+)가 된다.
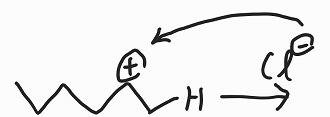
그 후, Cl은 양이온쪽의 옥텟규칙이 깨진 불안정한 부분과 결합한다.
Lewis 산인 HCl의 H가 전자를 빼앗아가며 반응이 시작(친전자성)되었고, π결합이 두 개의 σ결합이 되었다(첨가). 마지막으로는 탄소 양이온에 Cl의 할로젠이 붙으며 반응이 마무리(친전자성)되었다.
친핵성 반응 nucleophilicity
친핵성: 핵하고 친한, 원자핵의 양성자(+)를 좋아한다 원자의 세상에서 양성자(+)를 좋아하는 것은 전자(-)이므로 전자쌍 주개(전자를 제공)를 시약으로 사용한다.
- Lewis 염기 을 시약으로 사용한다.
즉, 반응을
주도하는 물질이 친핵체일때 친핵성 반응이며, 반응의 시작부터 끝까지 전자를 제공하는 물질이 주도한다.
전자를 자꾸 제공하므로 음이온성 중간 물질(-)들이 생성된다.
분자 내의 가장 전자밀도 낮은 반결합성 orbital에서 반응이 일어난다.
친핵성 반응 중, 친핵성 치환 반응은 SN2와 SN1으로 나뉜다.
예) 친핵성 치환 반응
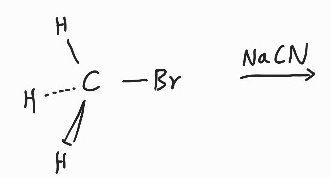
C와 Br중에서는 Br쪽으로 전자가 쏠려있다고 예상할 수 있다.
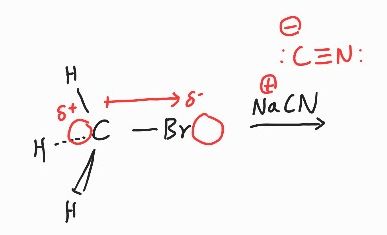
NaCN 중, Na는 +를 띠는 금속 양이온이고, CN에서 C가 음전하(-)를 띠고 있을 것이다. 탄소가 전기음성도가 상대적으로 낮으므로 전자를 제공하려고 한다(전자쌍 주개).
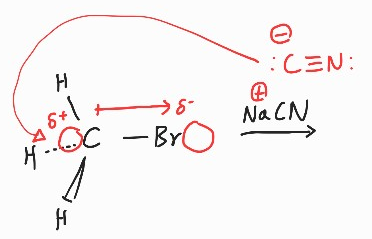
CN의 전자쌍 주개가 C로 전자를 밀어넣으면, Br쪽은 전자를 가지고 떨어져나간다. 기존의 H 결합은 전자가 밀고 들어와 밀려 나갈 것이라고 예상할 수 있다.

Lewis 염기인 NaCN의 C가 전자를 제공하며 반응이 시작(친핵성)되었고, Br대신 CN이 붙었다(치환). 마지막으로 Br(-)에 Na(+)가 붙으며 반응이 마무리(친핵성)되었다.
'Chemistry > Organic' 카테고리의 다른 글
| 유기 화학 / SN2와 SN1 (0) | 2021.04.18 |
|---|---|
| 유기 화학 / SN1 / 친핵성 치환 반응 (0) | 2021.04.18 |
| 유기 화학 / SN2 / 친핵성 치환 반응 (0) | 2021.04.18 |
| INDEX / Organic Chemistry / 유기 화학 (0) | 2020.06.19 |
| 4. 알데하이드와 케톤의 반응 (0) | 2020.05.29 |
| 2. 알데하이드와 케톤의 명명 (명명법 / 여러 알데하이드와 케톤) (0) | 2020.05.29 |
| 유기 화학 / 유기 금속 시약 (0) | 2020.05.26 |